
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- E modifikuara e fundit 2025-01-22 17:10.
Pra, ne llogarit atë duke marrë të peshuarit masë të secilit prej izotopeve dhe duke i mbledhur së bashku. Pra, për të parën masë , ne do të shumëzojmë 0,50% të 84 (amu - masë atomike njësi) = 0,042 amu, dhe shtojeni në 9,9% të 86 amu = 8,51 amu, e kështu me radhë.
Më pas, dikush mund të pyesë gjithashtu, si e llogaritni masën mesatare atomike?
Llogaritja e masës mesatare atomike Të masa mesatare atomike e një elementi është shuma e masat i izotopeve të tij, secili i shumëzuar me bollëkun e tij natyror (dhjetra e lidhur me përqindjen e atomet të atij elementi që janë të një izotopi të caktuar). Masa mesatare atomike = f1M1 + f2M2 +…
E dini gjithashtu, cilat tre lloje informacioni nevojiten për të llogaritur një masë mesatare atomike? Numri i izotopeve që ekzistojnë për elementin. Të Atomike Numri për Elementin. Përqindja e bollëkut të secilit izotop.
Dikush mund të pyesë gjithashtu, cila është vlera më e afërt me masën atomike të stronciumit?
Stronciumi . Në raportin e tij të vitit 1961, Komisioni rekomandoi Ar(Sr) = 87.62 bazuar në masë -përcaktimi spektrometrik i Nier. Kjo vlerë u rishikua në Ar(Sr) = 87.62 (1) në 1969 dhe mbetet i pandryshuar që nga ajo kohë.
Sa ka një masë prej 1 amu?
Një njësi e masës atomike (e simbolizuar AMU ose amu) përcaktohet saktësisht si 1/12 e masës së një atomi të karbonit-12. Atomi i karbonit-12 (C-12) ka gjashtë protonet dhe gjashtë neutronet në bërthamën e saj. Në terma të pasaktë, një AMU është mesatarja e proton masa e pushimit dhe neutron masë pushimi.
Recommended:
Sa është masa mesatare atomike e një atomi?

Masa mesatare atomike e një elementi është shuma e masave të izotopeve të tij, secili i shumëzuar me bollëkun e tij natyror (dhjetra e lidhur me përqindjen e atomeve të atij elementi që janë të një izotopi të caktuar). Masa mesatare atomike = f1M1 + f2M2 +
Si përcaktohet masa mesatare atomike e paraqitur në tabelën periodike?

Masa mesatare atomike për një element llogaritet duke mbledhur masat e izotopeve të elementit, secili shumëzuar me bollëkun e tij natyror në Tokë. Kur bëni ndonjë llogaritje të masës që përfshin elementë ose komponime, përdorni gjithmonë masën atomike mesatare, e cila mund të gjendet në tabelën periodike
Si të llogarisni masën atomike të borit?
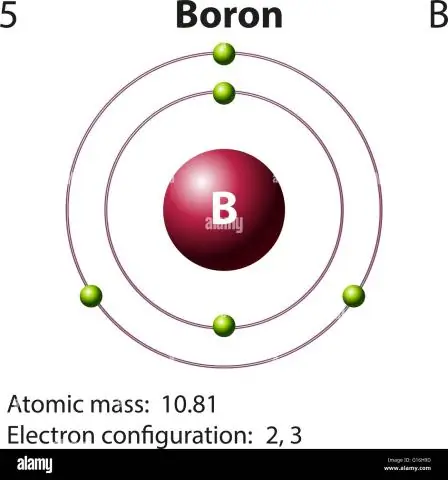
Për borin, ky ekuacion do të duket kështu: 5 protone + 5 neutrone = 10 njësi të masës atomike (AMU) ose, për izotopin më të zakonshëm të borit (afërsisht 5 protone + 6 neutrone = 11 AMU
Si i llogaritni problemet e praktikës së masës atomike?

VIDEO Atëherë, si i zgjidhni problemet e masës atomike? te llogarit të masë atomike të një atomi të vetëm të një elementi, shtoni deri masë të protoneve dhe neutroneve. Shembull: Gjeni masë atomike i një izotopi karboni që ka 7 neutrone.
Cili element ka masën atomike më të madhe?

Ununoctium është elementi më i rëndë, por është krijuar nga njeriu. Elementi më i rëndë natyror është uraniumi (numri atomik 92, pesha atomike 238,0289)
