
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- E modifikuara e fundit 2025-01-22 17:10.
Në Modeli Bohr , elektroni trajtohet si grimcë në orbita fikse rreth bërthamës. Modeli i Schrodinger-it (Mekanike Kuantike Model ) lejoi që elektroni të pushtonte hapësirën tredimensionale. Prandaj kërkoheshin tre koordinata, ose tre numra kuantikë, për të përshkruar shpërndarjen e elektroneve në atom.
Në mënyrë të ngjashme, dikush mund të pyesë, si ndryshon modeli i Schrodinger nga kuizleti i Bohr-it?
Modeli i Bohr-it tregon elektronet që lëvizin rreth bërthamës si "orbita" rrethore. Modeli i Schrodinger-it tregon elektronet që lëvizin rreth bërthamës në lëvizje të ngjashme me valë të quajtura "orbitale". Të ndryshme atomet kanë të ndryshme elektronkonfiguracionet, pra ato lëshojnë a të ndryshme spektrat e dritës.
Po kështu, cili është modeli Schrodinger? Një i fuqishëm model i atomit u zhvillua nga Erwin Schrödinger në vitin 1926. The Modeli i Shrodingerit supozon se elektroni është një valë dhe përpiqet të përshkruajë rajonet në hapësirë, ose orbitalet, ku ka më shumë gjasa të gjenden elektronet.
Thjesht kështu, si e ndryshoi Schrodinger modelin e Bohr-it?
Në Modeli Bohr , elektronet janë grimca që zënë vetëm orbita të caktuara të energjisë fikse rreth bërthamës. Modeli i Shrodingerit , elektronet sillen valë të qëndrueshme që kanë probabilitet më të madh për të qenë në disa rajone të hapësirës (orbitale) sesa në të tjerat.
Cila është ngjashmëria dhe ndryshimi midis modelit Bohr dhe modelit të mekanikës kuantike?
Të Modeli Bohr i trajton elektronet me vlerë të njëjtën si të degjeneruar, pra që kanë të njëjtën energji. Pozicionet e zëna nga elektronet: kryesore ngjashmëri ndërmjet dy modele është se në të dy elektronet janë të ndryshme distancat nga bërthama, që korrespondojnë me të ndryshme energjitë.
Recommended:
Si ndryshon bazalt toleiit nga shumica e shkëmbinjve vullkanikë?

Shkëmbinjtë në serinë e magmës toleitike klasifikohen si subalkaline (përmbajnë më pak natrium se disa bazalt të tjerë) dhe dallohen nga shkëmbinjtë në serinë e magmës kalko-alkaline nga gjendja redoks e magmës nga e cila kristalizohen (magmat toleitike janë reduktuar; kalc- magmat alkaline oksidohen)
Si ndryshon një lidhje kovalente nga një kuizlet i lidhjes jonike?

Dallimi midis një lidhjeje jonike dhe një lidhje kovalente është se një lidhje kovalente formohet kur dy atome ndajnë elektrone. Lidhjet jonike janë forca që mbajnë së bashku forcat elektrostatike të tërheqjeve midis joneve të ngarkuar në mënyrë të kundërt. Lidhjet jonike kanë një ndryshim elektronegativiteti më të madh ose të barabartë me 2
Si ndryshon forma e një qelize bimore nga ajo e një qelize shtazore?
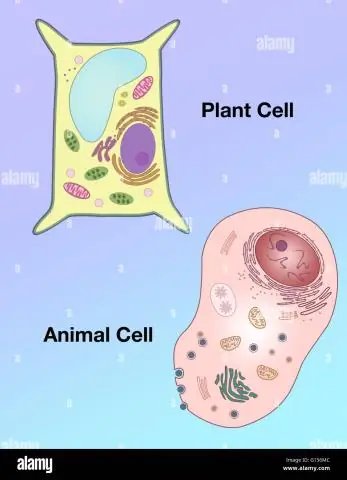
Vakuolat: Qelizat bimore kanë një vakuole të madhe, ndërsa qelizat shtazore përmbajnë vakuola të shumta të vogla. Forma: Qelizat bimore kanë një formë më të rregullt (përgjithësisht drejtkëndore), ndërsa qelizat e kafshëve kanë forma të çrregullta. Lizozomet: janë përgjithësisht të pranishme në qelizat shtazore, ndërsa mungojnë në qelizat bimore
Si ndryshon sheqeri në ARN nga sheqeri në ADN?
ADN-ja përmban sheqerin deoksiribozë, ndërsa ARN përmban ribozën e sheqerit. Dallimi i vetëm midis ribozës dhe deoksiribozës është se riboza ka një grup më shumë -OH sesa deoksiriboza, e cila ka -H të lidhur me karbonin e dytë (2') në unazë. ADN-ja është një molekulë me dy zinxhirë, ndërsa ARN është një molekulë me një zinxhir
Si ndryshon një ndryshim kimik nga një kuizlet i ndryshimit fizik?
Cili është ndryshimi midis një ndryshimi kimik dhe fizik? Ndryshimet kimike përfshijnë prodhimin e një lënde krejtësisht të re përmes thyerjes dhe rirregullimit të atomeve. Ndryshimet fizike janë zakonisht të kthyeshme dhe nuk përfshijnë krijimin e elementeve ose komponimeve të ndryshme
