
Përmbajtje:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- E modifikuara e fundit 2025-01-22 17:10.
Tampon
- Nëse keni vetëm një të dobët acid . Përcaktoni përqendrimin e acid (duke supozuar se nuk ka disociim). Kërkoni ose përcaktoni Ka.
- Nëse keni një të dobët acid DHE konjugati bazë . Zgjidheni për tampon.
- Nëse keni vetëm konjugatin bazë . Zgjidheni për pH të bazë duke përdorur Kb dhe ekuacioni i hidrolizës.
Prandaj, si e bëni titrimin e bazës acidike?
Procedura e titrimit
- Shpëlajeni buretën me tretësirën standarde, pipetën me tretësirën e panjohur dhe balonën konike me ujë të distiluar.
- Vendosni një vëllim të matur me saktësi të analitit në balonën Erlenmeyer duke përdorur pipetën, së bashku me disa pika tregues.
Po kështu, si e llogaritni titrimin? Përdorni formula e titrimit . Nëse titranti dhe analiti kanë një raport mol 1:1, atëherë formulë është molariteti (M) i acidit x vëllimi (V) i acidit = molariteti (M) e bazës x vëllimit (V) e bazës. ( Molariteti eshte përqendrimi të një tretësire të shprehur si numri i moleve të lëndës së tretur për litër tretësirë.)
Përveç kësaj, a është F një bazë e fortë apo e dobët?
Prandaj, unë- është më e qëndrueshme, dhe më pak themelore, ndërsa F - është më pak e qëndrueshme dhe më themelore. Baza të forta ndërveprojnë plotësisht me të fortë acide si HCl për të formuar një kripë dhe ujë në një reaksion neutralizimi. Të tjera baza të forta janë okside të tretshme, si Na2O dhe kripërat e tretshme të hidroksidit. Baza të forta janë të fortë elektroliteve.
Për çfarë përdoret titrimi?
A titrimi është një teknikë ku është një zgjidhje me përqendrim të njohur e mesuar me Përcaktoni përqendrimin e një tretësire të panjohur. Në mënyrë tipike, titranti (tretësira e njohur) shtohet nga një buretë në një sasi të njohur të analitit (tretësira e panjohur) derisa reaksioni të përfundojë.
Recommended:
Cilat janë 9 hapat e sintezës së proteinave?

Sinteza e proteinave: hapi 1 - sinjal. ndodh një sinjal që kërkon të prodhohet një proteinë specifike. sinteza e proteinave: hapi 2 - acetilimi. pse gjenet e ADN-së nuk janë gjithmonë lehtësisht të arritshme. sinteza e proteinave: hapi 3 - ndarja. bazat e ADN-së. Çiftet e bazave të ADN-së. sinteza e proteinave: hapi 4 - transkriptimi. transkriptimi
Cilat janë hapat e përfshirë në pllakëzim?

Më poshtë përshkruhen hapat e ndërmarrë në një proces tipik të elektrikimit me zink. Hapi 1 - Pastrimi i Nënshtresës. Hapi 2 – Aktivizimi i Nënshtresës. Hapi 3 – Përgatitja e Solucionit të Plating. Hapi 4 - Elektrikimi me zink. Hapi 5 - Shpëlarje dhe tharje
Cilat janë hapat e një rruge të transmetimit të sinjalit?
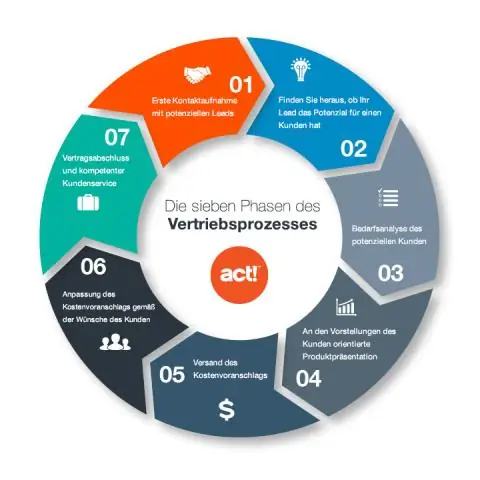
Tre faza të sinjalizimit të qelizave Sinjalizimi i qelizave mund të ndahet në 3 faza. Pritja: Një qelizë zbulon një molekulë sinjalizuese nga jashtë qelizës. Transduksioni: Kur molekula sinjalizuese lidh receptorin, ajo ndryshon proteinën e receptorit në një farë mënyre. Përgjigja: Më në fund, sinjali shkakton një përgjigje specifike celulare
Cilat janë hapat për zgjidhjen e problemeve me fjalë?
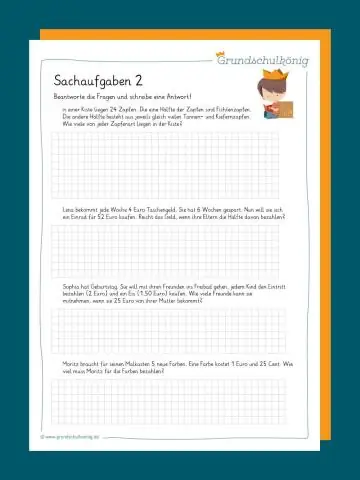
Hapat e thjeshtë për zgjidhjen e problemeve me fjalë Lexoni problemin. Filloni duke lexuar problemin me kujdes. Identifikoni dhe listoni faktet. Kuptoni saktësisht se çfarë kërkon problemi. Eliminoni informacionin e tepërt. Kushtojini vëmendje njësive matëse. Vizatoni një diagram. Gjeni ose zhvilloni një formulë. Konsultohuni me një referencë
Cilat janë hapat për zgjidhjen e pabarazive me dy hapa?

Duhen dy hapa për të zgjidhur një ekuacion ose pabarazi që ka më shumë se një veprim: Thjeshtoni duke përdorur inversin e mbledhjes ose zbritjes. Thjeshtoni më tej duke përdorur inversin e shumëzimit ose pjesëtimit
