
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- E modifikuara e fundit 2025-01-22 17:10.
Në zero - kinetikën e rendit , norma e bën një reagim nuk varet nga përqendrimi i substratit. T 1 /2 formula për një reagim i rendit zero sugjeron gjysma - jeta varet nga sasia e përqendrimit fillestar dhe normë konstante.
Më pas, dikush mund të pyesë gjithashtu, sa është gjysma e jetës për një reagim të rendit zero?
96 sekonda
Gjithashtu, si e gjeni gjysmën e jetës së një konstante norme? Strategjia:
- Përdorni ekuacionin 3 për të llogaritur gjysmën e jetës së reaksionit.
- Shumëzoni përqendrimin fillestar me 1/2 me fuqinë që korrespondon me numrin e gjysmë jetëve për të marrë përqendrimet e mbetura pas atyre gjysmë jetësh.
- Zbrisni përqendrimin e mbetur nga përqendrimi fillestar.
Lidhur me këtë, pse gjysma e jetës së një reaksioni të rendit të parë është konstante?
Me fjalë të tjera, përqendrimi fillestar i reaktantit nuk ka ndikim në gjysma - jeta të reagimi , dmth gjysma - jeta është konstante pavarësisht nga përqendrimi i reaktantit.
A varet gjysma e jetës së një reaksioni të rendit zero nga përqendrimi fillestar i reaktantit?
Prandaj, nga ekuacioni i mësipërm ne mund konkludojnë se Gjysma e jetës së një reaksioni të rendit zero varet në përqendrimi fillestar të specieve reaguese dhe konstante të shpejtësisë, k. Është drejtpërdrejt proporcionale me përqendrimi fillestar i reaktantit kurse është në përpjesëtim të zhdrejtë me konstanten e shpejtësisë, k.
Recommended:
Cilat janë ngjashmëritë dhe ndryshimet domethënëse midis shpejtësisë dhe shpejtësisë?
Grafiku i krahasimit Baza për shpejtësinë e krahasimit Shpejtësia e ndryshimit të distancës Ndryshimi i zhvendosjes Kur trupi kthehet në pozicionin e tij fillestar Nuk do të jetë zero Nuk do të jetë zero Objekti lëvizës Shpejtësia e objektit në lëvizje nuk mund të jetë kurrë negative. Shpejtësia e objektit në lëvizje mund të jetë pozitive, negative ose zero
Cila është formula e reaksionit të rendit zero?

2 ka formën e ekuacionit algjebrik për një vijë të drejtë, y = mx + b, me y = [A], mx = −kt dhe b = [A]0.) Në një reaksion të rendit zero, shpejtësia konstantja duhet të ketë të njëjtat njësi si shpejtësia e reagimit, zakonisht mole për litër në sekondë
Cili është ndryshimi midis shpejtësisë dhe shpejtësisë me shembuj?
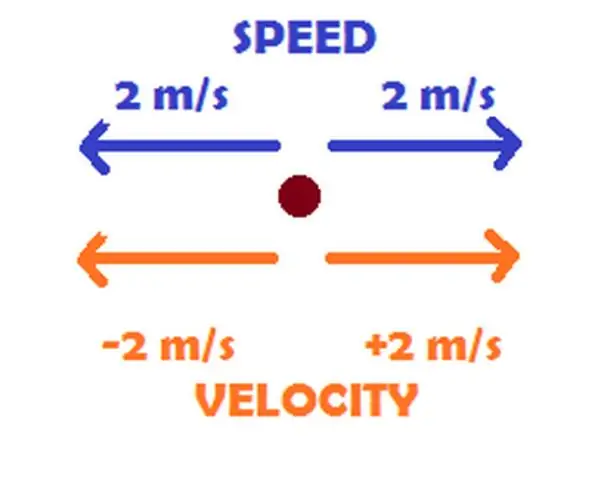
Arsyeja është e thjeshtë. Shpejtësia është shpejtësia e kohës në të cilën një objekt lëviz përgjatë një shtegu, ndërsa shpejtësia është shpejtësia dhe drejtimi i lëvizjes së një objekti. Për shembull, 50 km/orë (31 mph) përshkruan shpejtësinë me të cilën një makinë udhëton përgjatë një rruge, ndërsa 50 km/orë në perëndim përshkruan shpejtësinë me të cilën po udhëton
Sa është gjysma e jetës së reaksionit të rendit zero?

Gjysma e jetës së një reaksioni është koha e nevojshme për të ulur sasinë e një reaktanti të caktuar për gjysmën. Gjysma e jetës së një reaksioni të rendit zero zvogëlohet ndërsa përqendrimi fillestar i reaktantit në reaksion zvogëlohet
Çfarë ndikon në konstantën e shpejtësisë k?

Një rritje e temperaturës rrit normën konstante dhe rrjedhimisht normën. Një mospërqendrim i rritjes rrit normën, por jo konstanten e normës. Temperatura ndikon në k dhe k ndikon në Rso, temperatura ndikon të dyja ndërsa përqendrimi ndikon vetëm Shpejtësia e reaksioneve
