
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- E modifikuara e fundit 2025-01-22 17:10.
Nëse keni nevojë përdorni kjo ekuacioni , thjesht gjeni butonin "ln" në kalkulatorin tuaj. Ti mundesh përdorni ekuacionin Arrhenius për të treguar efektin e një ndryshimi të temperaturës në konstante të shpejtësisë - dhe për rrjedhojë në shpejtësinë e reaksionit. Nëse konstanta e shpejtësisë dyfishohet, për shembull, po ashtu do të jetë edhe shpejtësia e reaksionit.
Në mënyrë të ngjashme, cila është formula për energjinë e aktivizimit?
Përcaktimi i Energjisë së Aktivizimit. Vini re se kur ekuacioni Arrhenius riorganizohet si më sipër ai është një ekuacion linear me formën y = mx + b; y është ln(k), x është 1/T dhe m është -Ea/R. Energjia e aktivizimit për reaksionin mund të përcaktohet duke gjetur shpat të linjës.
Për më tepër, cilat janë njësitë për K? Nga modeli i njësive mund të themi se për një reaksion të rendit kinetik n, the njësive e k janë: k = 1/tc^(n-1), duke kujtuar se c është sasia për litër e shprehur në masë ose molaritet dhe n është rendi kinetik.
Atëherë, cilat janë njësitë e energjisë së aktivizimit në ekuacionin Arrhenius?
ku k përfaqëson konstanten e shpejtësisë, Ea eshte energjia e aktivizimit , R është konstanta e gazit (8,3145 J/K mol), dhe T është temperatura e shprehur në Kelvin. A njihet si faktori i frekuencës, që ka njësive e L mol-1 s-1, dhe merr parasysh shpeshtësinë e reaksioneve dhe gjasat e orientimit të saktë molekular.
Sa është konstanta e shpejtësisë k?
Të normë konstante , k , është një proporcionalitet konstante që tregon lidhjen ndërmjet përqendrimit molar të reaktantëve dhe norma të një reaksioni kimik. Të normë konstante mund të gjenden në mënyrë eksperimentale, duke përdorur përqendrimet molare të reaktantëve dhe renditjen e reaksionit.
Recommended:
Cilat janë produktet në ekuacionin molekular për reaksionin e plotë të neutralizimit të hidroksidit ujor të bariumit dhe acidit nitrik?

Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O. Hidroksidi i bariumit reagon me acidin nitrik për të prodhuar nitrat bariumi dhe ujë
Cilat janë variablat në ekuacionin e Bernulit?

Variablat P 1 P_1 P1?P, nënshkrimi i fillimit, 1, nënshkrimi fundor, v 1 v_1 v1?v, nënshkrimi i fillimit, 1, nënshkrimi i përfundimit, h 1 h_1 h1?h, nënshkrimi i fillimit, 1, nënshkrimi i fundit i referohen presionit , shpejtësia dhe lartësia e lëngut në pikën 1, ndërsa variablat P 2 P_2 P2?P, nënshkrimi i fillimit, 2, nënshkrimi fundor, v 2 v_2 v2?v, fillimi
Çfarë është produkti dhe reaktanti në ekuacionin kimik?

Të gjitha reaksionet kimike përfshijnë si reagues ashtu edhe produkte. Reaktantët janë substanca që fillojnë një reaksion kimik, dhe produktet janë substanca që prodhohen në reaksion
Kur duhet ta përdorni serinë e aktiviteteve si e përdorni atë?

Përdoret për të përcaktuar produktet e reaksioneve të zhvendosjes së vetme, ku metali A do të zëvendësojë një metal tjetër B në një tretësirë nëse A është më i lartë në seri. Seritë e aktivitetit të disa prej metaleve më të zakonshme, të renditura në rend zbritës të reaktivitetit
Kur duhet të përdorni korrelacionin dhe kur duhet të përdorni regresionin e thjeshtë linear?
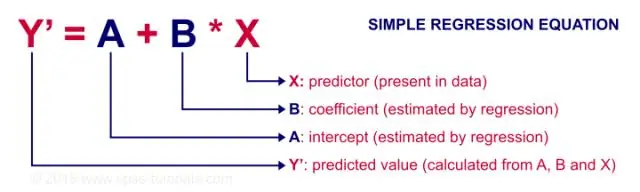
Regresioni përdoret kryesisht për të ndërtuar modele/ekuacione për të parashikuar një përgjigje kyçe, Y, nga një grup variablash parashikues (X). Korrelacioni përdoret kryesisht për të përmbledhur shpejt dhe në mënyrë koncize drejtimin dhe forcën e marrëdhënieve midis një grupi prej 2 ose më shumë ndryshoresh numerike
