
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- E modifikuara e fundit 2025-01-22 17:10.
Sipas Teoria molekulare kinetike , një rritje në temperatura do të rrisë mesataren energjia kinetike të molekulat . Si grimcat lëvizin më shpejt, ata ka të ngjarë të godasin më shpesh buzën e enës. Rritja e energjia kinetike të grimcat do të rrisë presionin e gazit.
Përkatësisht, si ndikon temperatura në energjinë mesatare kinetike të molekulave të gazit?
Vëllimi kundrejt Temperatura : Ngritja e temperatura e një gazit rrit energji mesatare kinetike dhe për këtë arsye shpejtësia rms (dhe mesatare shpejtësia) e molekulat e gazit . Prandaj si temperatura rritet, të molekulat përplasen me muret e kontejnerëve të tyre më shpesh dhe me forcë më të madhe.
Në mënyrë të ngjashme, çfarë ndodh me energjinë kinetike të një gazi nëse rritni temperaturën? Të temperatura të gazi është proporcionale me mesataren energjia kinetike të molekulave të tij. Grimcat që lëvizin më shpejt do të përplasen me muret e kontejnerit më shpesh dhe me forcë më të madhe. Kjo bën që forca në muret e enës të rrit dhe kështu presioni rritet.
Pra, si ndikon temperatura në energjinë kinetike?
Energjia kinetike eshte energji që ka një objekt për shkak të lëvizjes së tij. Molekulat në një substancë kanë një varg prej kinetike energjitë sepse nuk lëvizin të gjitha me të njëjtën shpejtësi. Ndërsa një substancë thith nxehtësinë, grimcat lëvizin më shpejt, kështu që mesatarja energjia kinetike dhe për këtë arsye temperatura rritet.
Si ndikon temperatura në energjinë kinetike të grimcave të materies?
Kur energjia e nxehtësisë i shtohet një substance, kjo rezulton në një rritje të energjia kinetike e saj grimcat , domethënë, grimcat lëvizin me shpejtësi më të larta. Temperatura është drejtpërdrejt proporcionale me energjia kinetike . Nëse temperatura rritet, atëherë energjia kinetike të grimcat gjithashtu rritet.
Recommended:
Çfarë është drejtpërdrejt proporcionale me energjinë mesatare kinetike?

Energjia mesatare kinetike e një grumbulli grimcash gazi është drejtpërdrejt proporcionale vetëm me temperaturën absolute
Çfarë u bën energjia kinetike molekulave?

Teoria molekulare kinetike thotë se grimcat e gazit janë në lëvizje të vazhdueshme dhe shfaqin përplasje krejtësisht elastike. Teoria molekulare kinetike mund të përdoret për të shpjeguar ligjet e Charles dhe Boyle. Energjia mesatare kinetike e një grumbulli grimcash gazi është drejtpërdrejt proporcionale vetëm me temperaturën absolute
Çfarë krijon presionin e gazit dhe si ndryshon ai me ndryshimet në energjinë kinetike?

Presioni i gazit shkaktohet nga përplasjet e grimcave të gazit me pjesën e brendshme të enës, ndërsa ato përplasen dhe ushtrojnë një forcë në muret e enës. Pastaj gazi nxehet. Me rritjen e temperaturës së gazit, grimcat fitojnë energji kinetike dhe shpejtësia e tyre rritet
Kur vëllimi i një kampioni të gazit zvogëlohet presioni i mostrës së gazit?
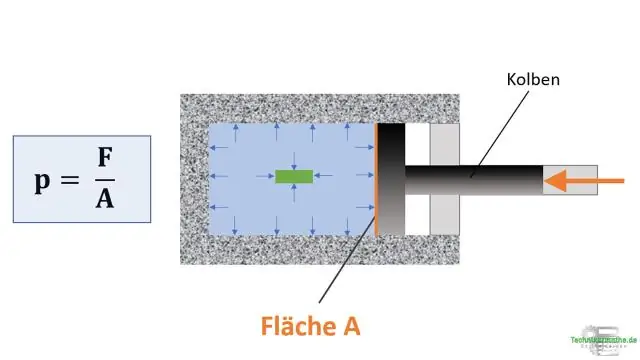
Presioni në rënie Ligji i kombinuar i gazit thotë se presioni i një gazi lidhet në mënyrë të zhdrejtë me vëllimin dhe drejtpërdrejt me temperaturën. Nëse temperatura mbahet konstante, ekuacioni reduktohet në ligjin e Boyle. Prandaj, nëse ulni presionin e një sasie fikse gazi, vëllimi i tij do të rritet
Si e llogaritni energjinë kinetike rrotulluese?
Energjia kinetike rrotulluese mund të shprehet si: Erotacion=12Iω2 E rrotulluese = 1 2 I ω 2 ku ω është shpejtësia këndore dhe I është momenti i inercisë rreth boshtit të rrotullimit. Puna mekanike e aplikuar gjatë rrotullimit është çift rrotullimi shumëfish i këndit të rrotullimit: W=τθ W = τ θ
